Autora:
Raquel Juliana Leiton Caicedo
Química pura, Magister en Educación con énfasis en Ciencias Naturales. Docente de Química y Ciencias Naturales en educación media. Experiencia en investigación educativa y diseño de recursos didácticos para la enseñanza de la química.
Ley periódica
El concepto de elemento químico ha evolucionado significativamente desde las ideas filosóficas de la antigüedad hasta las teorías científicas modernas. Aristóteles, en la antigua Grecia, introdujo la idea de los cuatro elementos básicos, estableciendo una noción abstracta que prevaleció hasta la modernidad. Posteriormente, Lavoisier definió los elementos químicos desde una perspectiva experimental, basándose en propiedades observables y medibles, lo que marcó el inicio de la química como ciencia experimental. Con la contribución de Dalton, se desarrolló la teoría atómica química, introduciendo el concepto de átomos como unidades de combinación, fundamentales para comprender las propiedades y comportamientos de los elementos.
A lo largo del siglo XIX, se destacaron dos avances cruciales: la hipótesis de Prout, que enfatizaba el peso atómico como criterio de ordenamiento, y las triadas de Döbereiner, que relacionaban reactividad química y peso atómico. Estas ideas influyeron en Mendeleev, quien, motivado por la enseñanza, propuso un ordenamiento de los elementos basado en su periodicidad. Mendeleev formuló la ley periódica, indicando que las propiedades de los elementos y sus compuestos dependen periódicamente de sus pesos atómicos. Aunque utilizó triadas para su clasificación, rechazó las hipótesis previas, integrando un enfoque abstracto y coherente con la teoría atómica.
Con el desarrollo de la física cuántica y el estudio de la radiactividad en el siglo XX, la tabla periódica enfrentó desafíos debido a la crisis de los isótopos. Paneth resolvió este problema al introducir el número atómico como criterio principal para clasificar los elementos, asegurando la vigencia del sistema periódico. Este enfoque reduccionista, basado en la mecánica cuántica, se consolidó al relacionar la configuración electrónica externa con las propiedades químicas de los elementos.
A pesar de los avances de la física cuántica, se ha destacado la relevancia de las hipótesis atómicas químicas previas. Estas han demostrado ser fundamentales para describir fenómenos que la física no puede abordar completamente, evidenciando la coexistencia de descripciones químicas y físicas sin supremacía entre ambas. Lombardi y Labarca han propuesto abandonar la asimetría entre química y física, destacando que ambas disciplinas ofrecen perspectivas complementarias.
El concepto de afinidad química también ha sido clave en la enseñanza de la química. Desde la prehistoria, cuando se daban explicaciones míticas a las transformaciones materiales, hasta el siglo XVIII, la afinidad evolucionó hacia una comprensión experimental. Lemery propuso la primera teoría sobre química ácido-base basada en estructuras mecánicas, mientras que Geoffrey introdujo la primera tabla de afinidades en 1718, precursora de la tabla periódica moderna. Davy, a finales del siglo XVIII, relacionó afinidad química con cargas eléctricas, avanzando hacia una comprensión electrostática de las interacciones químicas.
Fuente: Carabelli, P., Farré, A. S., & Raviolo, A. (2023). Fundamentos históricos y filosóficos de una estrategia lúdica para la enseñanza de la ley periódica. pp. 5-10.
Actividad N°1
Aprendizajes:
• Relacionar la cantidad de electrones, protones y neutrones con el comportamiento del átomo.
• Identificar la disposición de los elementos en grupos y periodos de la tabla periódica para comprender su organización y las relaciones entre sus propiedades.
• Reconocer la ubicación y clasificación de los elementos en los grupos o familias de la tabla periódica.
1. Pretest
Resultados de la prueba
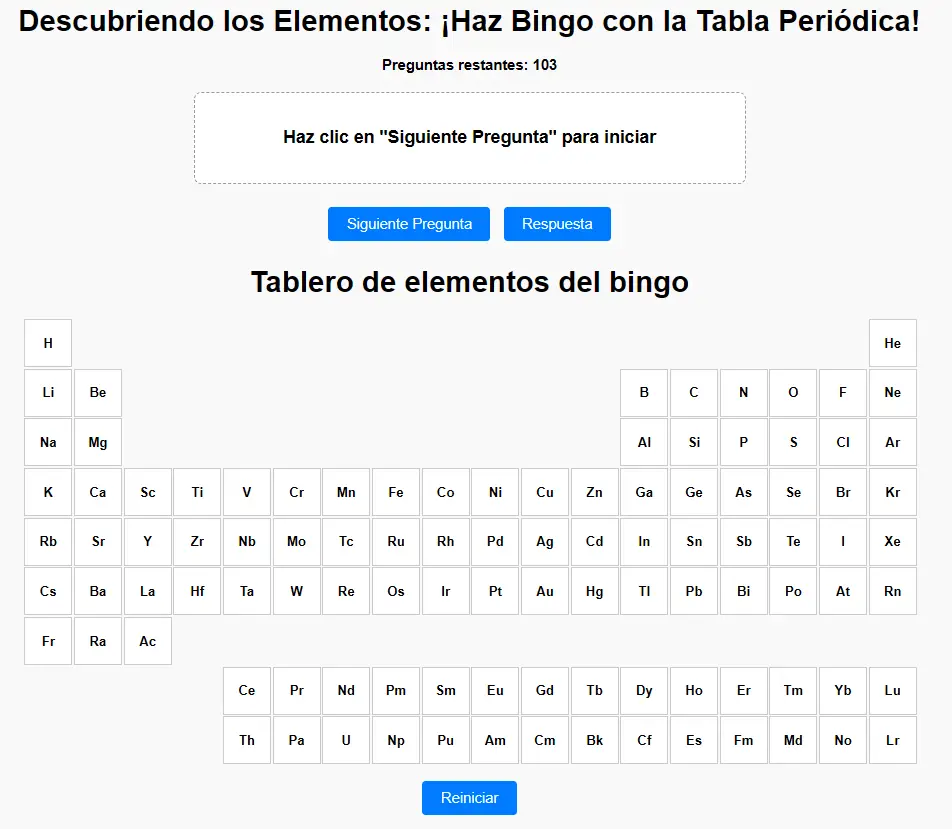
Recurso gamificado 1. "Exploración de los elementos:Descubriendo los Elementos: ¡Haz Bingo con la Tabla Periódica!"
Este primer recurso gamificado tendrá como propósitos:
•Reforzar el conocimiento de los estudiantes sobre la organización de la tabla periódica, incluyendo el reconocimiento de los elementos por sus símbolos y nombres, así como su ubicación según los grupos, periodos y familias.
• Promover el aprendizaje significativo y activo en los estudiantes, a través de la resolución de preguntas que les permiten aplicar el conocimiento sobre la ley periódica, los elementos químicos y sus propiedades, estimulando su pensamiento crítico y su capacidad para explicar fenómenos químicos.
• Analizar las características y propiedades de los elementos durante la ejecución del recurso gamificado, identificando sus comportamientos químicos y agrupándolos adecuadamente en la tabla periódica. Esto les permitirá practicar habilidades de síntesis y aplicar el conocimiento adquirido de manera práctica y dinámica.
Instrucciones:
1. El profesor debe dar click en el botón "Tablero principal" y cada estudiante en el botón "Tablas"
2. Cada estudiante recibirá una tarjeta de bingo con un conjunto de 9 casillas que tendrán registros de nombres o símbolos de elementos químicos.
3. Desarrollo del Juego: El profesor leerá una pregunta sobre un elemento químico. La pregunta puede referirse a características como: el grupo al que pertenece el elemento (bloque A o B), el periodo, su familia, o algún comportamiento químico destacado del elemento.
4. Los estudiantes deberán escuchar y resolver la pregunta. Al responder correctamente, podrán marcar la casilla correspondiente en su tarjeta de bingo.
Ejemplo de pregunta: "¿Qué elemento alcalinotérreo es esencial para la formación de huesos en los seres humanos? Pistas: Se encuentra en el grupo 2 y es crucial para la salud ósea."
5. Condiciones para Hacer Bingo: El primer estudiante que complete una fila, columna o diagonal de su tarjeta de bingo con respuestas correctas, deberá levantar la mano para indicar que ha ganado.
6. El estudiante deberá llenar la tabla colocada en el tablero del salón con la siguiente información de los elementos cubiertos durante el juego que le permitieron ganar: Nombre del elemento, Símbolo del elemento, Grupo (definir si pertenece al bloque A o B), Periodo del elemento, Familia del elemento (por ejemplo, halógenos, gases nobles, etc.), Descripción de dos comportamientos químicos del elemento tapado en su casilla ganadora (por ejemplo, reactividad con agua, formación de compuestos, etc.).
7. Conclusión del Juego: Un estudiante elegido al azar verificará la información proporcionada por el estudiante ganador, de esta forma se realiza una coevaluación.
8. Se podrá continuar jugando hasta que todos los estudiantes muestren habilidad para coevaluar a sus compañeros.
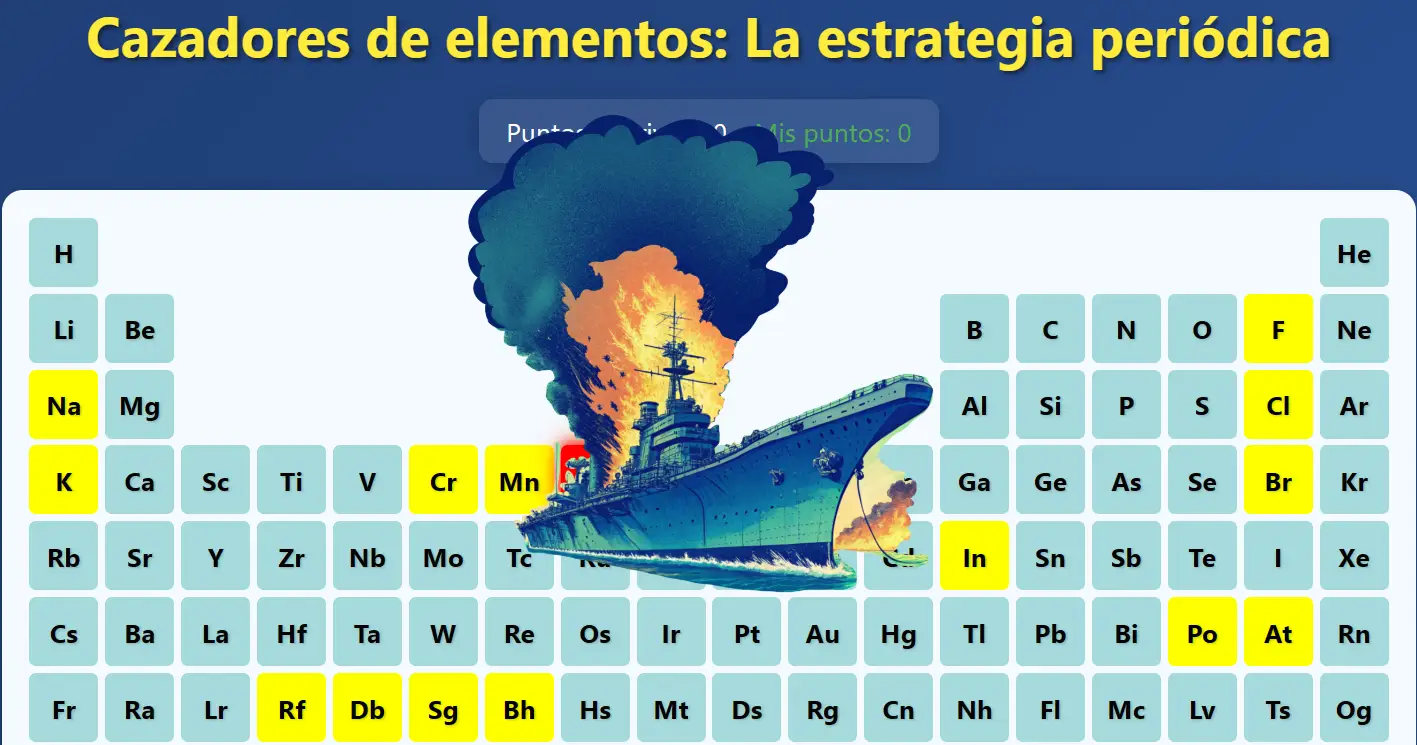
Recurso gamificado 2. "Cazadores de elementos: La estrategia periódica"
Para el segundo recurso gamificado se promoverán los siguientes propósitos:
•Fomentar el aprendizaje activo y la toma de decisiones, incentivando la participación colaborativa y el pensamiento estratégico para localizar las embarcaciones del oponente mientras aplican conceptos sobre la disposición de los elementos en la tabla periódica.
• Estimular el pensamiento crítico y la resolución de problemas, al vincular las respuestas correctas en preguntas de selección múltiple con puntos de avance, favoreciendo el análisis y aplicación del conocimiento sobre propiedades químicas.
• Desarrollar habilidades de clasificación y síntesis, al identificar las familias químicas de los elementos impactados y relacionarlas con sus propiedades y ubicación en la tabla periódica.
• Fomentar la reflexión y la argumentación científica, permitiendo que los estudiantes analicen y discutan cómo la posición de los elementos en la tabla periódica influye en sus características químicas, promoviendo un aprendizaje significativo.
Instrucciones:
1. Formar grupos de dos estudiantes para jugar en parejas.
2. Cada jugador deberá ubicarse uno frente al otro, de manera que no puedan ver la pantalla del computador del contrincante.
3. Para iniciar el recurso gamificado, cada grupo debe dar clic en la imagen que se encuentra al final de las instrucciones denominada tablero principal.
4. Cada jugador coloca sus "embarcaciones" en la tabla, ubicándolas en casillas consecutivas. Las casillas seleccionadas se marcarán en color amarillo.
5. Cada jugador dispone de un total de 7 embarcaciones:
• 2 embarcaciones de 3 casillas consecutivas.
• 1 embarcación de 4 casillas consecutivas.
• 1 embarcación de 2 casillas consecutivas.
• 3 embarcaciones de 1 casilla cada una.
6. Por turnos, cada jugador comunica al oponente la coordenada del ataque, indicando el grupo y el período de un elemento.
7. Si el ataque acierta una de las casillas amarillas o una embarcación, la casilla correspondiente se marcará de rojo y el atacante ganará 10 puntos. Si el ataque falla, el jugador atacado debe responder una pregunta de selección múltiple. Si responde correctamente, gana 10 puntos; si falla, la casilla se marcará en negro y no se sumarán puntos.
8. Cuando se derriba una embarcación, el jugador que la ha eliminado debe identificar la familia o familias químicas de los elementos involucrados (por ejemplo, "Metales de transición", "Halógenos", etc.).
9. El juego termina cuando uno de los judadores ha impactado todas las embarcaciones de su oponente. Reflexión final. Al finalizar, los estudiantes discutirán las características de las familias químicas identificadas y cómo la ubicación en la tabla periódica determina sus propiedades.
10. Para definir el ganador de una partida, cada jugador deberá sumar "Mis puntos" con los puntos que tiene el contrincante en "Puntos del rival".
11. Para jugar nuevamente, el jugador que ganó deberá hacer clic en las casillas restantes que son de color amarillo.
2. Postest
Resultados de la prueba
Periodic Law
The concept of chemical elements has evolved significantly from the philosophical ideas of antiquity to modern scientific theories. Aristotle, in ancient Greece, introduced the idea of the four basic elements, establishing an abstract notion that prevailed until modern times. Later, Lavoisier defined chemical elements from an experimental perspective, based on observable and measurable properties, which marked the beginning of chemistry as an experimental science. With Dalton's contribution, the chemical atomic theory was developed, introducing the concept of atoms as units of combination, fundamental for understanding the properties and behaviors of elements.
Throughout the 19th century, two crucial advances stood out: Prout's hypothesis, which emphasized atomic weight as an ordering criterion, and Döbereiner's triads, which related chemical reactivity and atomic weight. These ideas influenced Mendeleev, who, motivated by teaching, proposed an ordering of elements based on their periodicity. Mendeleev formulated the periodic law, indicating that the properties of elements and their compounds depend periodically on their atomic weights. Although he used triads for his classification, he rejected previous hypotheses, integrating an abstract approach consistent with atomic theory.
With the development of quantum physics and the study of radioactivity in the 20th century, the periodic table faced challenges due to the crisis of isotopes. Paneth solved this problem by introducing the atomic number as the main criterion for classifying elements, ensuring the validity of the periodic system. This reductionist approach, based on quantum mechanics, was consolidated by relating the external electronic configuration with the chemical properties of the elements.
Despite the advances in quantum physics, the relevance of previous chemical atomic hypotheses has been highlighted. These have proven to be fundamental for describing phenomena that physics cannot fully address, demonstrating the coexistence of chemical and physical descriptions without supremacy between them. Lombardi and Labarca have proposed abandoning the asymmetry between chemistry and physics, emphasizing that both disciplines offer complementary perspectives.
The concept of chemical affinity has also been key in the teaching of chemistry. From prehistory, when mythical explanations were given to material transformations, until the 18th century, affinity evolved towards an experimental understanding. Lemery proposed the first theory on acid-base chemistry based on mechanical structures, while Geoffrey introduced the first table of affinities in 1718, a precursor to the modern periodic table. Davy, at the end of the 18th century, related chemical affinity with electrical charges, advancing towards an electrostatic understanding of chemical interactions.
Source: Carabelli, P., Farré, A. S., & Raviolo, A. (2023). Historical and philosophical foundations of a playful strategy for teaching the periodic law. pp. 5-10.
Activity No. 1
Learning Objectives:
• Relate the number of electrons, protons, and neutrons to the behavior of the atom.
• Identify the arrangement of elements in groups and periods of the periodic table to understand their organization and the relationships between their properties.
• Recognize the location and classification of elements in the groups or families of the periodic table.
1. Pretest
Test Results
Gamified Resource 1. "Exploring the Elements: Discover the Elements: Play Bingo with the Periodic Table!"
This first gamified resource will have the following purposes:
• Reinforce students' knowledge about the organization of the periodic table, including the recognition of elements by their symbols and names, as well as their location according to groups, periods, and families.
• Promote meaningful and active learning in students, through the resolution of questions that allow them to apply knowledge about the periodic law, chemical elements, and their properties, stimulating their critical thinking and their ability to explain chemical phenomena.
• Analyze the characteristics and properties of the elements during the execution of the gamified resource, identifying their chemical behaviors and grouping them appropriately in the periodic table. This will allow them to practice synthesis skills and apply the acquired knowledge in a practical and dynamic way.
Instructions:
1. The teacher should click on the "Main Board" button and each student on the "Tables" button.
2. Each student will receive a bingo card with a set of 9 squares that will have records of names or symbols of chemical elements.
3. Game Development: The teacher will read a question about a chemical element. The question may refer to characteristics such as: the group to which the element belongs (block A or B), the period, its family, or some outstanding chemical behavior of the element.
4. Students must listen to and solve the question. When answering correctly, they can mark the corresponding square on their bingo card.
Example question: "What alkaline earth element is essential for bone formation in humans? Clues: It is found in group 2 and is crucial for bone health."
5. Conditions for Making Bingo: The first student who completes a row, column, or diagonal of their bingo card with correct answers, should raise their hand to indicate that they have won.
6. The student must fill in the table placed on the classroom board with the following information of the elements covered during the game that allowed them to win: Name of the element, Symbol of the element, Group (define if it belongs to block A or B), Period of the element, Family of the element (for example, halogens, noble gases, etc.), Description of two chemical behaviors of the element covered in their winning square (for example, reactivity with water, formation of compounds, etc.).
7. Conclusion of the Game: A randomly chosen student will verify the information provided by the winning student, thus performing a co-evaluation.
8. The game can continue until all students show the ability to co-evaluate their peers.
Gamified Resource 2. "Element Hunters: The Periodic Strategy"
For the second gamified resource, the following purposes will be promoted:
• Foster active learning and decision-making, encouraging collaborative participation and strategic thinking to locate the opponent's vessels while applying concepts about the arrangement of elements in the periodic table.
• Stimulate critical thinking and problem-solving, by linking correct answers in multiple-choice questions with progress points, favoring the analysis and application of knowledge about chemical properties.
• Develop classification and synthesis skills, by identifying the chemical families of the impacted elements and relating them to their properties and location in the periodic table.
• Encourage reflection and scientific argumentation, allowing students to analyze and discuss how the position of elements in the periodic table influences their chemical characteristics, promoting meaningful learning.
Instructions:
1. Form groups of two students to play in pairs.
2. Each player should sit facing each other, so that they cannot see the computer screen of the opponent.
3. To start the gamified resource, each group must click on the image found at the end of the instructions called the main board.
4. Each player places their "vessels" on the table, locating them in consecutive squares. The selected squares will be marked in yellow.
5. Each player has a total of 7 vessels:
• 2 vessels of 3 consecutive squares.
• 1 vessel of 4 consecutive squares.
• 1 vessel of 2 consecutive squares.
• 3 vessels of 1 square each.
6. Taking turns, each player communicates to the opponent the attack coordinate, indicating the group and the period of an element.
7. If the attack hits one of the yellow squares or a vessel, the corresponding square will be marked in red and the attacker will earn 10 points. If the attack fails, the attacked player must answer a multiple-choice question. If they answer correctly, they earn 10 points; if they fail, the square will be marked in black and no points will be added.
8. When a vessel is destroyed, the player who has eliminated it must identify the chemical family or families of the elements involved (for example, "Transition metals", "Halogens", etc.).
9. The game ends when one of the players has impacted all the opponent's vessels. Final reflection: At the end, students will discuss the characteristics of the identified chemical families and how the location in the periodic table determines their properties.
10. To determine the winner of a match, each player must add "My points" with the points the opponent has in "Opponent's points".
11. To play again, the player who won must click on the remaining squares that are yellow.
2. Posttest
Test Results